Dans le programme d’immunologie de première, au coeur de l’immunité adaptative et une fois passés les TP emblématiques (Ouchterlony, ELISA), le professeur pourrait se retrouver en manque d’inspiration pour mettre les élèves en activité autour des notions du programme ne se prêtant pas à des manipulations de paillasse. Pour contourner cet obstacle, il peut être intéressant de fournir aux élèves un bagage de connaissances utiles, à découvrir avant le TP, puis de proposer in situ, lors du TP, différentes activités permettant soit d’utiliser ces connaissances soit de comprendre comment elles ont été construites. C’est ce que l’on propose ici, avec un menu de logiciels appropriés et en choisissant comme fil conducteur le déterminisme de la sécrétion d’anticorps.
EXTRAIT du programme de spécialité SVT de première - L’immunité adaptative
| Connaissances | Capacités, attitudes |
|---|---|
| L’immunité adaptative complète l’immunité innée chez les vertébrés. Elle assure une action spécifique contre des motifs moléculaires portés par des agents infectieux ou des cellules anormales. Elle met en jeu des molécules et des cellules particulières, notamment les anticorps et les cellules qui les produisent. Associée à l’immunité innée, elle réussit le plus souvent à éliminer la cause du déclenchement de la réaction immunitaire |
Recenser, extraire et exploiter des informations, y compris expérimentales, sur les cellules et les molécules intervenant dans l’immunité́ adaptative. |
| Cadre de référence des compétences numériques (CRCN) | |
|---|---|
| Communication et collaboration |
|
| Informations et données |
|
Voici la fiche présentant la connaissance des scientifiques, à lire avant la classe :
Remarque : de mutiples outils existent pour créer des QCM en ligne. On peut citer par exemple Netquizweb,Socrative, Quizinière, ou tout simplement les applications offertes par l’ENT Mon lycee.net
QCM - Choisir l’unique proposition exacte pour chaque question :
1. Les cellules productrices d’anticorps sont :
– les lymphocytes B
– les lymphocytes T CD4
– les lymphocytes T CD8
– les plasmocytes
2. Pour que le lymphocyte approprié se différencie en cellule productrice d’anticorps, il faut :
– qu’il soit en contact avec des LT CD4
– qu’il reçoive des messagers chimiques en provenance des LT CD4
– qu’il soit en contact avec des LT CD8
– qu’il reçoive des messagers chimiques en provenance des LT CD8
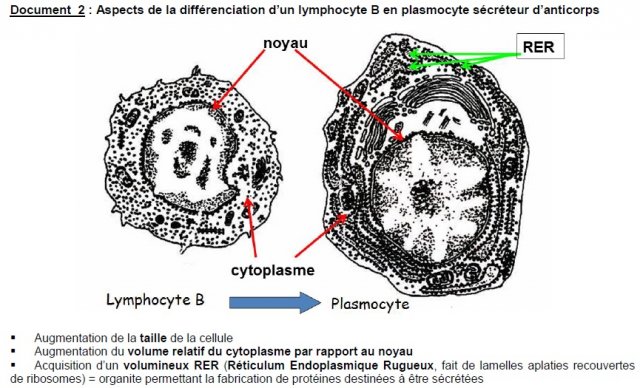
3. Par rapport à la cellule dont il dérive, un plasmocyte montre :
– un développement important du noyau par rapport au cytoplasme
– un déclin des fonctions sécrétoires
– un développement des organites cytoplasmiques impliqués dans la production d’anticorps membranaires
– un développement du réticulum endoplasmique rugueux
Les activités pendant la séance sont les suivantes :
- Résoudre une étude de cas (logiciel Cytométrie)
- Exploiter un modèle numérique pour corroborer le modèle des scientifiques (un logiciel multi-agent : NetBioDyn ou Edu’modèles)
- Quantifier l’adaptation fonctionnelle des plasmocytes (logiciel Mesurim)
Résoudre une étude de cas (logiciel Cytométrie)
Recherche à mener
Monsieur Y a un taux très bas de gammaglobulines (anticorps) alors que ses lymphocytes B, cellules à l’origine de la production d’anticorps, sont normalement présents. Les médecins diagnostiquent que monsieur Y est atteint du syndrome d’immunodéficience acquise (SIDA).
« Le SIDA ou syndrome d’immunodéficience acquise est le dernier stade de l’infection par le VIH (Virus de l’Immunodéficience Humaine) et finit par la mort de l’organisme infecté, des suites de maladies opportunistes. En médecine humaine ou vétérinaire, on appelle maladie opportuniste une maladie due à des germes habituellement peu agressifs mais qui sont susceptibles de provoquer de graves complications en affectant des personnes ayant un système immunitaire très affaibli »
Ressources
– Logiciel cytométrie, à télécharger sur la plate-forme acces de l’Institut Français de l’Education :
http://acces.ens-lyon.fr/acces/ress...
– Données cytométriques : fichier « SuiviSida.fcs » correspondant aux échantillons sanguins d’un individu sain (sujet X = témoin) et d’un individu atteint de SIDA (Monsieur Y = « cas grave »). Ce jeu de données est déjà contenu dans le logiciel à télécharger.
– Informations scientifiques sur le principe de la cytométrie et le logiciel cytométrie (document élaboré à partir des travaux de Jean-François Madre publiés sur la plate-forme acces de l’Ifé)
Un exemple de déroulement
Dans un premier temps, on s’intéresse à l’individu X (témoin). On recherche des informations sur les effectifs de LTCD4 chez ce patient. Pour cela, il faut successivement :
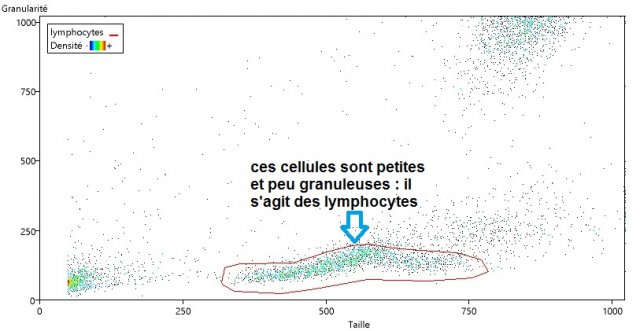
(1) Restreindre l’échantillon sanguin de ce sujet aux lymphocytes (cellules petites et peu granuleuses)
(2) Restreindre l’échantillon de lymphocytes aux LT (sous-population de lymphocytes possédant le marqueur CD3)
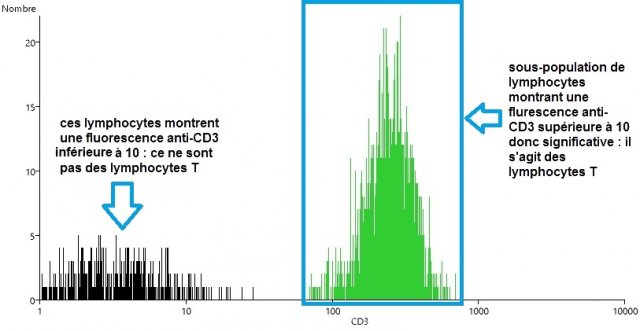
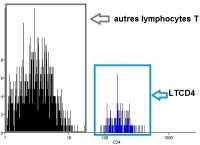
(3) Délimiter, parmi les LT, les LTCD4 (sous-population de lymphocytes T possédant le marqueur CD4).
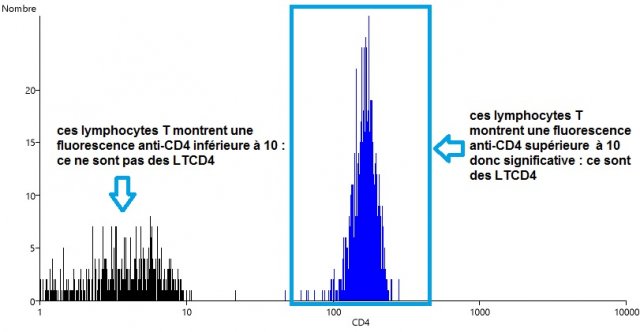
Dans un second temps, on s’intéresse à Monsieur Y, dont on veut expliquer l’immunodéficience. On réitère donc les opérations précédentes à partir de l’échantillon sanguin de ce patient. On obtient les résultats suivants :
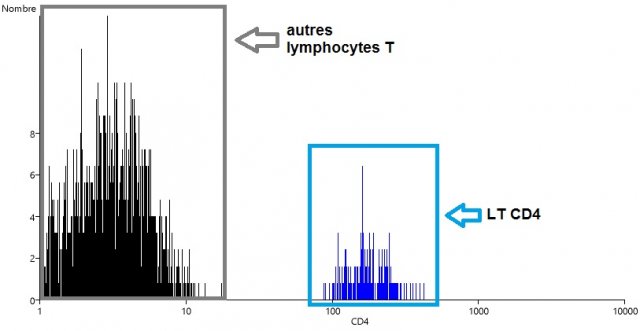
La comparaison des histogrammes "nombre de LT versus CD4" des deux individus montre que les LTCD4 sont beaucoup moins nombreux chez Monsieur Y que chez le sujet X.
Il ne reste alors plus qu’à utiliser la connaissance contenue dans la fiche présentant la connaissance des scientifiques pour expliquer l’immunodéficience de Monsieur Y.
Exploiter un modèle numérique pour corroborer le modèle des scientifiques (logiciel NetBioDyn ou logiciel Edu’modèles)
Recherche à mener
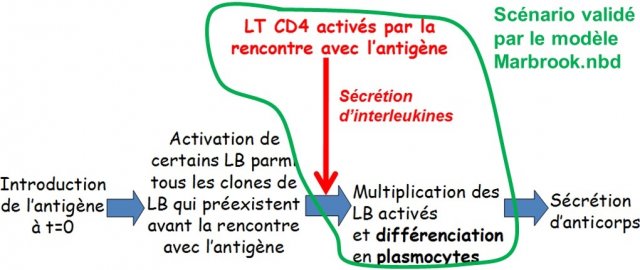
Le modèle de déclenchement de la sécrétion d’anticorps, proposé par les scientifiques, postule que les cellules productrices d’anticorps proviennent de LB issus de la sélection clonale et que des messagers chimiques fabriqués par des LTCD4 sont indispensables à cette production.
Une partie de cette connaissance est redevable aux travaux de l’immunologiste Marbrook qui mit au point en 1967 un ingénieux dispositif.
Ressources
– Document présentant le dispositif de Marbrook
– Logiciel NetBioDyn et modèle numérique marbrook.nbd
– OU logiciel Edu’modèles et modèle numérique marbrook.modele
Un exemple de déroulement
Avant toute utilisation du modèle numérique, les élèves peuvent réfléchir aux intentions de l’expérimentateur lors du placement initial des lymphocytes dans les deux chambres et aux résultats attendus dans le cadre du modèle scientifique qu’on souhaite valider :
– si les LB sont effectivement à l’origine de la production d’anticorps, aucun plasmocyte ne doit apparaître dans une chambre où les LB ne sont pas présents ;
– si les LTCD4 collaborent avec les LB pour permettre la production d’anticorps, aucun plasmocyte ne doit apparaître lorsque les LTCD4 sont absents et ceci malgré la présence des LB ;
– si les LTCD4 collaborent avec les LB par des messagers chimiques, des plasmocytes doivent apparaître dans la chambre où sont les LB même si les LTCD4 sont placés dans l’autre chambre, ceci parce que les deux chambres sont séparées par une membrane imperméable aux cellules mais perméable aux molécules.
Après cette réflexion, les expériences nécessaires peuvent être simulées au moyen du modèle numérique, dont le statut est de reproduire le réel :
| Simulation réalisée | Résultat | Déduction |
|---|---|---|
Simulation n°1 : 40 LB activés placés dans la chambre inférieure pour une durée de 500 tics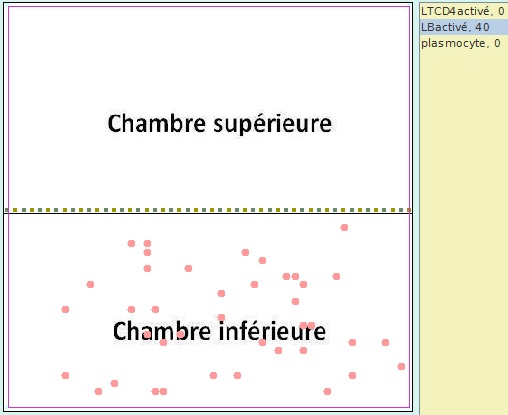
Simulation 1 - Situation à t=0
|
Pas de multiplication des LB ni d’apparition de de plasmocytes
Simulation 1 - Résultat à t= 500 tics
|
La seule présence des LB est insuffisante pour obtenir des plasmocytes |
Simulation n°2 : 40 LTCD4 activés et 40 LB activés placés ensemble dans la chambre inférieure pour une durée de 500 tics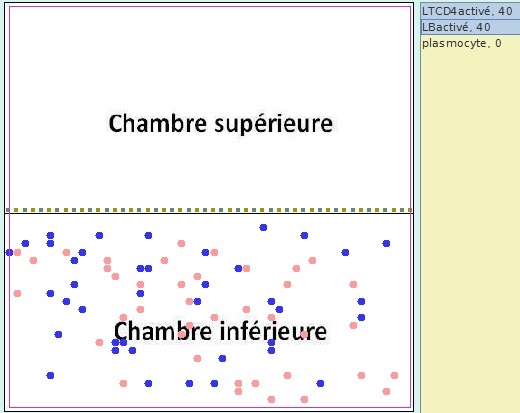
Simulation2 - Situation à t=0
|
Il y a multiplication des LB activés et apparition, dans la chambre où se trouvent les LB, de plasmocytes sécréteurs d’anticorps anti-Z.
Simulation 2 - Résultat à t=500 tics
|
Les LB sont les cellules à l’origine des plasmocytes sécréteurs d’anticorps. Les LTCD4 sont indispensables à la multiplication des LB activés et à leur différenciation en plasmocytes. |
Simulation n°3 : 40 LTCD4 activés placés dans la chambre supérieure et 40 LB activés placés dans la chambre inférieure pour une durée de 500 tics.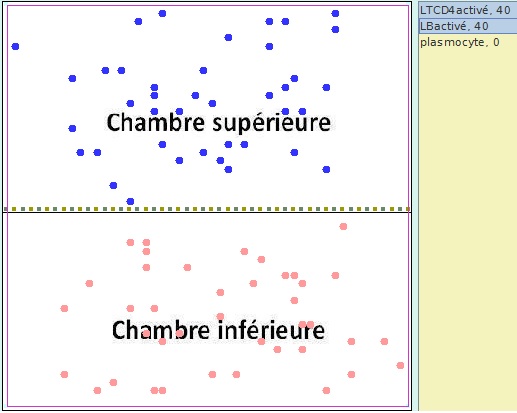
Simulation 3 - Situation à t=0
|
Comme dans la simulation 1, on observe la multiplication des LB activés et l’apparition de plasmocytes sécréteurs d’anticorps anti-Z.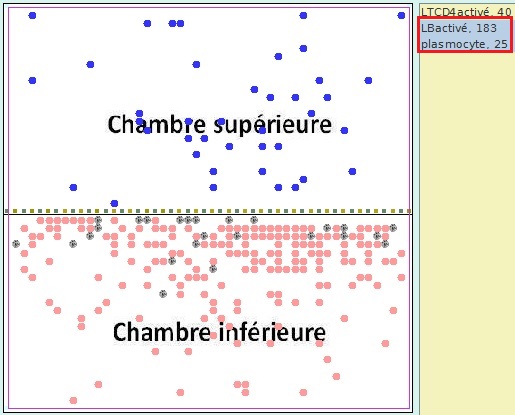
Simulation 3 - Situation à t=500 tics
|
L’interaction entre les LTCD4 et les LB ne s’effectue pas par des contacts cellulaires. C’est au moyen de messagers chimiques, les interleukines, que les LTCD4 activés stimulent la multiplication des LB activés et leur différenciation en en plasmocytes. |
>
Ci-dessous, un exemple de feuille-réponse pour la présentation et l’exploitation des travaux de Marbrook ainsi que des exemples de communication rendues par des élèves (livrés à eux-mêmes pour cette activité mais déjà familiarisés avec le logiciel multi-agents) :
Quantifier l’adaptation fonctionnelle des plasmocytes (logiciel Mesurim)
Les plasmocytes sont des cellules spécialisées montrant le développement de certaines structures cytoplasmiques, en particulier le réticulum endoplasmique rugueux indispensable à la synthèse des protéines circulantes (anticorps). Les scientifiques estiment à ce propos qu’un plasmocyte peut sécréter jusqu’à 2000 anticorps par seconde.
Recherche à mener
Un moyen de départager les deux étudiants consiste à mesurer le rapport nucléo-cytoplasmique pour chaque cellule.
Faire la preuve de la diminution du rapport nucléo-cytoplasmique lors de la différenciation d’un LB en plasmocyte et déterminer quel étudiant a finalement raison.
Ressources
- Logiciel Mesurim ou Mesurim2
- Electronographies de cellules immunitaires
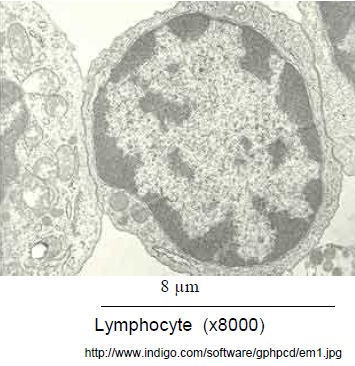 électronographie d’un lymphocyte B
électronographie d’un lymphocyte B

Ces électronographies sont empruntées à la banque de sujets d’ECE 2007.
Un exemple de déroulement
Il peut être utile de donner aux élèves les indications suivantes, à répéter pour chaque image :
– paramétrer l’échelle de l’image (ceci pour obtenir ultérieurement une surface en µm2 et non en pixels ...)
– faire un schéma de la cellule en décalquant simplement le cytoplasme et le noyau
– colorer différemment le noyau et le cytoplasme
– transférer le schéma puis mesurer les surfaces du noyau et du cytoplasme
– en déduire le rapport nucléo-cytoplasmique (= surface du noyau / surface du cytoplasme)
Dans le cas d’un lymphocyte B, on obtient le résultat suivant :
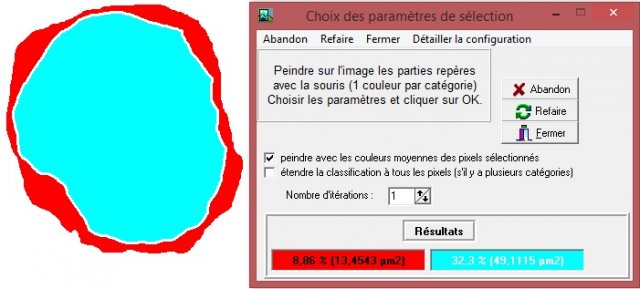
Ce lymphocyte B a donc un rapport nucléo-cytoplasmique égal à 49,1/13,5 soit 3,6.
Dans le cas d’un plasmocyte, on obtient le résultat suivant :
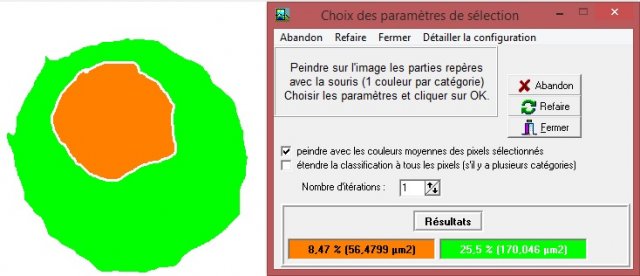
Ce plasmocyte a donc un rapport nucléo-cytoplasmique égal à 56,5/170 soit 0,33.
Pour aller plus loin, de nombreuses ressources proposées par l’Ifé autour de l’immunité adaptative :
- avec le logiciel NetBioDyn :
— > Réponse à médiation cellulaire :
— > Réponse à médiation humorale :
- avec les logiciels Rastop et GenieGen :
— > Sélection clonale des lymphocytes T :
— > Les anticorps solubles, des effecteurs spécifiques de leur antigène : (exemple de l’infection par le virus de la grippe)
— > vaccination contre la rougeole :
http://acces.ens-lyon.fr/acces/thematiques/immunite-et-vaccination/ressources-logicielles/nouveau-programme-immunologie-2012/la-memoire-immunitaire/vaccination-contre-la-rougeole-ressource
- avec le logiciel Cytométrie :
Réponse adaptative au virus de la grippe :
Auteur de cet article : Anne FLORIMOND, professeur de SVT au lycée Richelieu (Rueil-Malmaison), professeur formateur et professeur associé aux travaux de l’Ifé
Remerciements à :
– Laurent Guerre pour sa relecture et ses conseils
– Jean-François Madre pour ses développements autour du logiciel Cytométrie